CELL | 新型示踪剂可特异识别帕金森病重要致病蛋白
阿尔茨海默病(Alzheimer’s Disease,AD)是最常见的痴呆症类型,因其发病隐匿,病程较长,病情呈现进行性、加重性改变等特点,被认为是人类面临的最具挑战性的重大疾病之一。
作为必不可少的研究工具,AD动物模型被广泛用于深入探究AD发病分子机制,开展治疗药物的临床前研究以及寻找可靠的诊断生物标志物。
近日,深圳理工大学生命健康学院教授叶克强团队在Trends in Molecular Medicine(IF=12.8)杂志在线发表综述论文,系统阐述了当前在AD研究中最常用的小鼠模型,着重介绍了AD小鼠模型构建的最新进展,详细讨论了小鼠模型在AD研究中的优势和挑战,并对AD研究的未来趋势进行了展望。
深圳理工大学生命健康学院叶克强教授为该文章通讯作者,中国科学院深圳先进技术研究院副研究员钱政江为第一作者。
AD的临床症状主要包括认知和记忆功能障碍、日常生活能力下降以及精神行为异常等,其最重要的病理特征是中枢神经系统退行性变化,即脑内大量神经元的死亡,并伴随出现由β淀粉样蛋白(β amyloid,Aβ)多肽在细胞外沉积形成老年斑块,以及由高度磷酸化和截短的Tau病理蛋白在神经元内形成神经原纤维缠结。
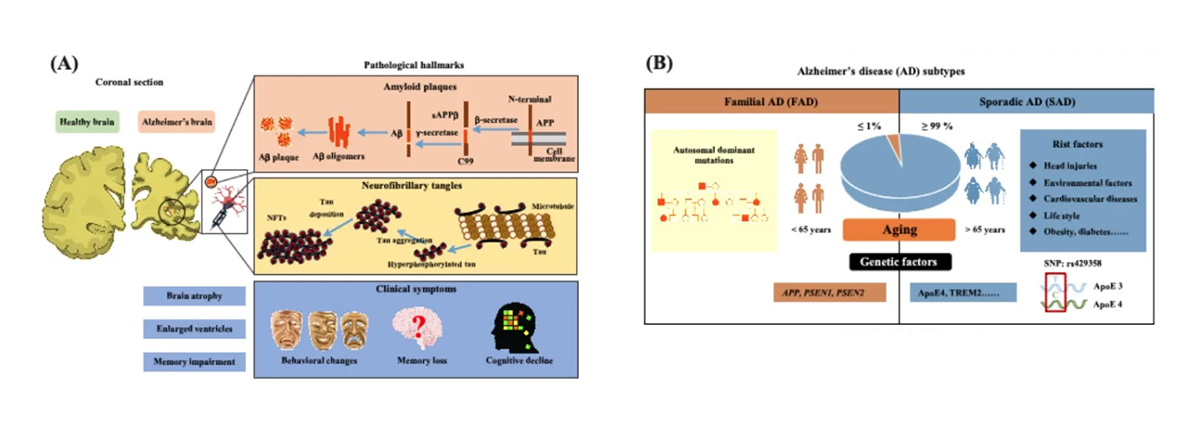
根据发生类型的不同,AD分为散发性和家族性两类。其中,散发性AD病人占比超过99%,主要由多种因素协同导致,而载脂蛋白ApoE4基因是最强的遗传风险因子;与相比,家族性AD只占极少部分(不到1%),主要由遗传突变因素控制,包括编码β淀粉样蛋白前体蛋白(Amyloid precursor protein,APP)、早老素1和2(Presenilin,PS1/2)等基因的突变导致。
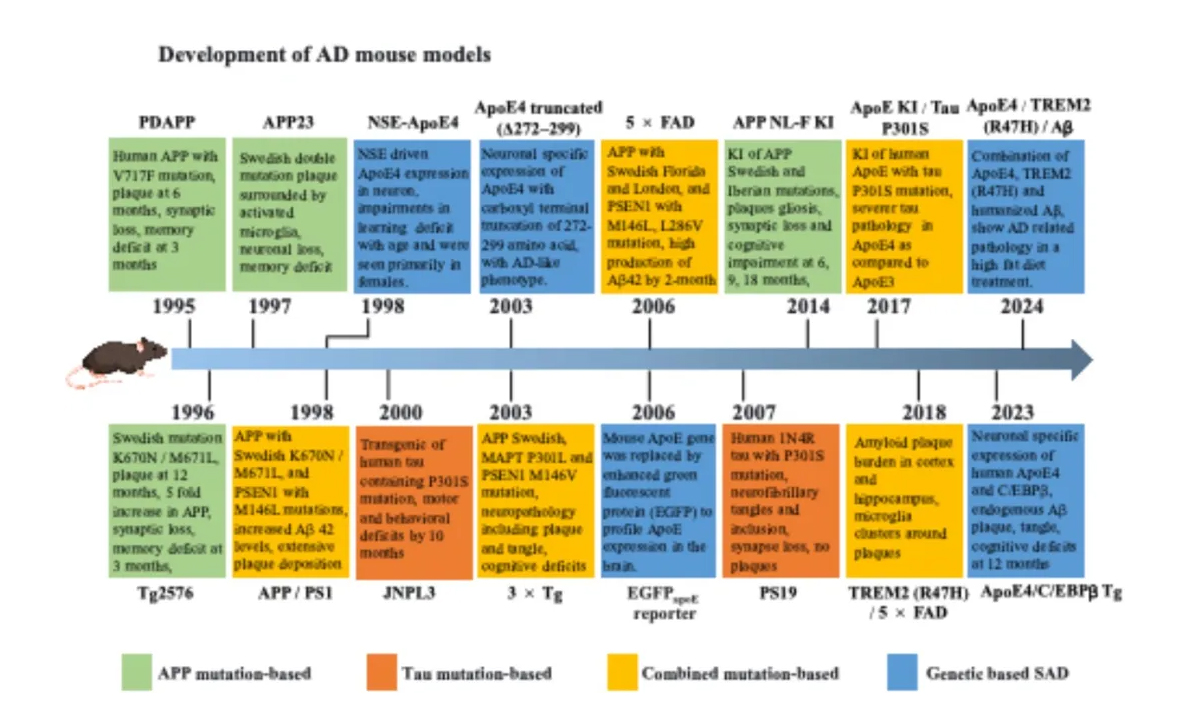
长期以来,AD动物模型大多是基于啮齿类小鼠构建,已经有超过200种小鼠模型用于实验室研究。当前,最常见的AD小鼠都是通过转基因过表达与AD形成密切相关APP、PS1等基因突变构建(如PDAPP, APP/PS1等转基因小鼠),主要用于模拟Aβ的病理特征;以及通过转基因过表达Tau蛋白的突变用于模拟Tau的病理特征(如JNPL3、PS19等转基因小鼠),尽管在AD病人中没有Tau基因的任何突变。这些转基因AD小鼠模型都能够较好地模拟AD的重要病理特征,但基于其过表达构建策略的缺陷,与AD病人真实的病理情况存在巨大差异。
因此,为了更好地模拟生理状态下基因突变导致的病理形成,近年来科学家们逐渐构建了一系列利用基因敲入策略的AD小鼠模型,包括APP NL-F、APP NL-G-F等,以及基于这些小鼠与其他AD小鼠模型杂交形成小鼠模型。此外,基于ApoE4、TREM2等与散发性AD形成相关风险因素小鼠模型的构建也引发关注,例如在神经元中特异性过表达ApoE4,以及TREM2(R47H)基因的敲入等。
总体来说,AD小鼠模型能够模拟重要AD的病理特征,但不能完全模拟AD病人的发病进程。此外,小鼠与人在进化、遗传背景以及生活环境等因素上存在巨大差异,因此基于AD小鼠模型的转化研究存在巨大挑战。
随着人类寿命的延长,AD病人数量的增加必将成为社会面临的巨大难题。未来针对AD的研究重点将集中在早期诊断、预防治疗和药物研发方面。
目前,利用PET影像学、液体生物标志物特别是血液生物标志物开展AD早期诊断的研究正在新兴发展,随着研究的深入,除了利用AD小鼠模型以外,综合多尺度的AD模型研究,包括细胞(iPSC)、类器官、不同动物模型(含非人灵长类模型)以及临床病人样本的分析,最终将为AD有效治疗提供解决途径。
本研究得到了国家自然科学基金重点项目(32330040)、国家自然科学基金青年基金项目(32200928)、广东省基础与应用研究项目(2023A1515030296)、深圳市面上项目(JCYJ20220531100802005)等基金的支持。